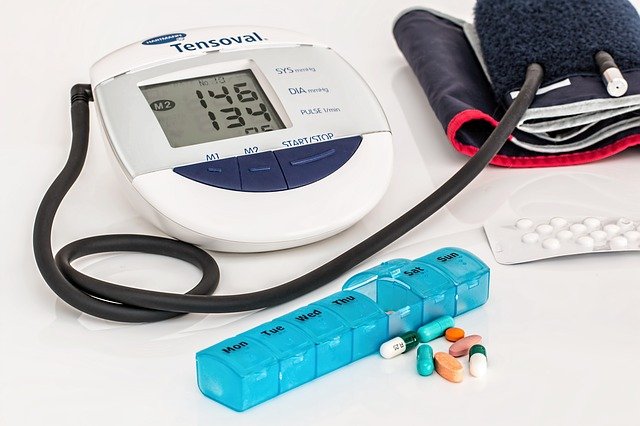
医疗器械文件翻译注意事项
Date: 2021-05-01 17:13:00Source: 志远翻译
2021年5月的医疗器械法规(MDR)截止日期很快就要到了,但即使在去年的延期之后,仍然有很多关于新法规的问题不断出现。
欧盟(EU)医疗器械法规(MDR) EU 2017/745于2017年5月25日生效,旨在提高临床安全性,支持制造商的公平市场准入。该条例的过渡期将持续到2021年春季,由于持续的大流行,过渡期延长了一年。2021年5月26日之后,必须按照新的欧盟多药耐药流程进行产品批准。随着过渡期的结束越来越近,这里有几个问题,我们继续定期看到一些简单的答案。
现行的医疗器械指令(MDD)真的需要改变吗?
总之,是的。MDD现在已经28岁了,在这段时间里,技术和人口结构变化如此之快,以至于MDD变得越来越无关紧要。举一个明显的例子,当MDD在1992年生效时,作为医疗设备的软件还不存在。与此同时,欧洲人口正在一分一秒地老龄化,互联网的出现导致在提供医疗设备技术信息方面越来越多地推动透明度。必须做点什么,结果就是多学科设计研究。
需要注意的最重要的变化是什么?
需要密切关注的一个领域是影响软件和设备的标准,这些标准以前没有受到监管。医疗器械制造商还需要考虑如何对现有器械进行分类,以及现有分类批准要求有何不同。需要来自临床试验和供应商的数据来证明设备和附件符合新的监管标准,公司需要建立跨职能团队来全面评估监管、保证一致性并实施变革。所有这些都需要在2021年5月前完成并通过医疗设备和系统的认证,因此负责的组织应该尽早忙于进行更改,以确保有足够的时间来认证受影响的设备。
欧盟MDR范围包含多少产品?
在现有的500,000种医疗设备中,估计约有314,000种需要根据欧盟医疗器械法规进行重新认证。
在过渡期结束之前,我们是否应该期待欧盟市场发展报告有任何变化?
欧盟委员会正在不断修改《药品生产质量管理条例》,为了澄清问题和提供对该条例的明确解释,已经进行了数百次修改。预计5月前会有更多的变化,这是公平的。
MDR认证的成本将与MDD认证的成本相当吗?
在评估成本时,有多个因素需要考虑(制造商的规模、地点的数量、产品的复杂性等)。但是,与《MDD公约》下的通知相比,通知机构用于多氯二苯并对二恶英和多氯二苯并呋喃通知的成本支出大幅增加。维护新的市场需求报告通知的努力已经增加,要求通知机构在市场需求报告证书有效期内监控认证制造商的特定任务也在增加。因此,相比之下,新的符合性评估的费用将大幅上升,至少在最初是这样。
医疗器械制造商的翻译流程受到了怎样的影响?
翻译在医疗器械行业一直很重要,帮助世界各地的人们识别和使用产品,无论他们说什么语言。根据新的药品说明书,使用说明(IFUs)、标签和安全信息的翻译更加重要——制造商以前可以依赖欧盟成员国来翻译,但现在将自己负责翻译。对翻译的多学科设计评审要求也要严格得多。现在,所有翻译都必须以销售设备的所有欧盟语言提供,所有翻译必须“清晰准确”,在进行ce标记之前需要一些翻译,所有医疗设备信息都将存储在一个名为EUDAMED的中欧数据库中,以便可以记录和交换所有适用语言的数据。
公司现在应该做些什么来在5月前实现合规?
负责任的医疗器械制造商应尽最大努力在2021年5月过渡期结束前实现合规,包括:
建立强大的质量管理体系
开始数据收集活动,包括带有准确制造商名称、零件号和零件描述的物料清单
准备对供应商进行欧盟计量吸入器和新物质清单的培训
分配足够的时间来绘制供应商响应图和收集信息
很明显,新法规将要求医疗器械制造商与其翻译和本地化供应商密切合作,以确保合规性。您的语言服务提供商(LSP)需要充分理解MDR的含义,并能够快速实施您需要的更改。供应链透明度和风险管理要求也将增加对物流服务提供商的需求,这些提供商能够证明经ISO 13485:2016等认证确认的质量方法。
医疗器械翻译
欧盟(EU)医疗器械法规(MDR) EU 2017/745于2017年5月25日生效,旨在提高临床安全性,支持制造商的公平市场准入。该条例的过渡期将持续到2021年春季,由于持续的大流行,过渡期延长了一年。2021年5月26日之后,必须按照新的欧盟多药耐药流程进行产品批准。随着过渡期的结束越来越近,这里有几个问题,我们继续定期看到一些简单的答案。

现行的医疗器械指令(MDD)真的需要改变吗?
总之,是的。MDD现在已经28岁了,在这段时间里,技术和人口结构变化如此之快,以至于MDD变得越来越无关紧要。举一个明显的例子,当MDD在1992年生效时,作为医疗设备的软件还不存在。与此同时,欧洲人口正在一分一秒地老龄化,互联网的出现导致在提供医疗设备技术信息方面越来越多地推动透明度。必须做点什么,结果就是多学科设计研究。
需要注意的最重要的变化是什么?
需要密切关注的一个领域是影响软件和设备的标准,这些标准以前没有受到监管。医疗器械制造商还需要考虑如何对现有器械进行分类,以及现有分类批准要求有何不同。需要来自临床试验和供应商的数据来证明设备和附件符合新的监管标准,公司需要建立跨职能团队来全面评估监管、保证一致性并实施变革。所有这些都需要在2021年5月前完成并通过医疗设备和系统的认证,因此负责的组织应该尽早忙于进行更改,以确保有足够的时间来认证受影响的设备。
欧盟MDR范围包含多少产品?
在现有的500,000种医疗设备中,估计约有314,000种需要根据欧盟医疗器械法规进行重新认证。
在过渡期结束之前,我们是否应该期待欧盟市场发展报告有任何变化?
欧盟委员会正在不断修改《药品生产质量管理条例》,为了澄清问题和提供对该条例的明确解释,已经进行了数百次修改。预计5月前会有更多的变化,这是公平的。
MDR认证的成本将与MDD认证的成本相当吗?
在评估成本时,有多个因素需要考虑(制造商的规模、地点的数量、产品的复杂性等)。但是,与《MDD公约》下的通知相比,通知机构用于多氯二苯并对二恶英和多氯二苯并呋喃通知的成本支出大幅增加。维护新的市场需求报告通知的努力已经增加,要求通知机构在市场需求报告证书有效期内监控认证制造商的特定任务也在增加。因此,相比之下,新的符合性评估的费用将大幅上升,至少在最初是这样。
医疗器械制造商的翻译流程受到了怎样的影响?
翻译在医疗器械行业一直很重要,帮助世界各地的人们识别和使用产品,无论他们说什么语言。根据新的药品说明书,使用说明(IFUs)、标签和安全信息的翻译更加重要——制造商以前可以依赖欧盟成员国来翻译,但现在将自己负责翻译。对翻译的多学科设计评审要求也要严格得多。现在,所有翻译都必须以销售设备的所有欧盟语言提供,所有翻译必须“清晰准确”,在进行ce标记之前需要一些翻译,所有医疗设备信息都将存储在一个名为EUDAMED的中欧数据库中,以便可以记录和交换所有适用语言的数据。
公司现在应该做些什么来在5月前实现合规?
负责任的医疗器械制造商应尽最大努力在2021年5月过渡期结束前实现合规,包括:
建立强大的质量管理体系
开始数据收集活动,包括带有准确制造商名称、零件号和零件描述的物料清单
准备对供应商进行欧盟计量吸入器和新物质清单的培训
分配足够的时间来绘制供应商响应图和收集信息
很明显,新法规将要求医疗器械制造商与其翻译和本地化供应商密切合作,以确保合规性。您的语言服务提供商(LSP)需要充分理解MDR的含义,并能够快速实施您需要的更改。供应链透明度和风险管理要求也将增加对物流服务提供商的需求,这些提供商能够证明经ISO 13485:2016等认证确认的质量方法。
医疗器械翻译
The End
- 上一篇:斯威士兰的翻译与本地化
- 下一篇:医学写作翻译